1.2 ポテンシャルステップテクニック(CA, CC, STEP)
これらのテクニックでは、ポテンシャルをある値から第2の値に変化させ、電流(クロノアンペロメトリー)または電荷(クロノクーロメトリー)応答を時間の関数としてモニターします(電荷は電流の積分であることに注意)。ある時間τの間、第2の電位に保持した後、ポテンシャルを(しばしば元のポテンシャル値である)第3の値に変化させます。それゆえに、ポテンシャルステップ実験はシングルステップ、またはダブルステップとなります。
一般変数 はクロノアンペロメトリーとクロノクーロメトリーでわずかに異なります。
クロノアンペロメトリーの場合、初期電位(初期E) と高電位、低電位が必要となります。ポテンシャルを初期電位から低電位 または高電位 に変化させます(これは初期P / N変数によって決まります)。時間τ(パルス幅)経過後に、ポテンシャルは反対の方向(低電位から高電位または高電位から低電位)に変化させ、τ時間この値の電位に保持します(図4 参照)。クロノクーロメトリーの場合、ポテンシャルは初期電位(初期E)と最終電位(最終E)となります(図5 参照)。


電流/ 電荷応答は初期電位と最終電位値に依存します。もしファラデー反応がどちらの電位でも起こらないなら(ファラデー反応とは溶液での分子種の電気分解です)、応答は電極の充電による電流となります(充電即ち容量性電流またはバックグラウンド電流)。
その応答は電流スパイクで指数関数的に減少します。しばしば、初期電位は ファラデー反応が起こらない電位にし、最終電位はファラデー反応が迅速に起こる電位にします。即ち、 電気化学活性な分子は作用電極の表面に到着するとすぐに 電気分解されます。電流の大きさはバルク溶液から作用電極表面への物質移動速度により決まります。即ち、拡散速度です。 拡散支配による電流は下記のCottrell 式によって与えられます。

ここで、
n = 電子移動数/ 分子当たり、 F = ファラデー定数(96,500C/mole)i = 電流(A)、C = 濃度(mol / cm3)、 t = 時間(s)A = 電極面積(cm2)、 D = 拡散係数(cm2 / s)
拡散支配によるファラデー電流はt-1/2 で減衰します(典型的なクロノアンペログラム、図6 参照)。
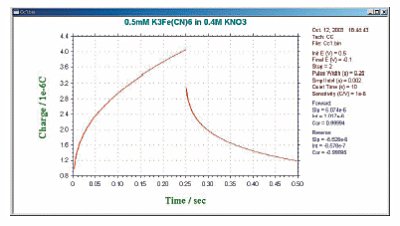
拡散支配による電荷(Qdiff)の同様な式は上式の積分となります。(即ちQはt1/2 に比例)そして典型的なクロノクーログラムを図7 に示します。

CA とCC 測定法は直線プロットの勾配を用いてn、C、A、Dの内の1つを決めるために使われます。但し、4 つのパラメータの内3 つは既知でなければなりません。しかし、他のテクニック(例えば、後述のパルステクニック)の方が検出下限は低く、そのためCA とCC は濃度測定には一般に使われません。AとDはしばしばこれらのテクニックを使って測定されています。
iとt-1/2 またはQ と t1/2 の間の関係は電流(または電荷)が拡散によって厳密にコントロールされる時間間隔を調べるために使用されます。図8 は時間に対するi/t-1/2のプロットです。 短時間における理論値からのズレはステップポテンシャルで作用電極を充電するのに必要な時間の長さによります。 長時間における理論値からのズレは自然対流によるものです。

図8. 電気化学システムの平面拡散条件における時間ウインドウを模式的にあらわすi / t -1/2(CA)プロット
CA とCC 測定法は絶対濃度測定には使用しませんが、電解された分子の均一系化学反応による濃度変化を測定するために使用されます。 これはダブルステップテクニックを使い、フォワードとバックワード電流(電荷)の比を測定することにより行なわれます。もしフォワードステップで電解後に生成物が化学反応を起こすならば、これらの生成物分子は逆ステップで電解用に供給されにくくなります。それ故、化学反応が速くなればなるほど 、逆ステップでの電流/ 電荷は小さくなります。化学反応速度は異なったパルス幅による電流(または電荷)比を測ることにより算出されます。
もし電子移動が迅速に起こらない値を最終電位にするならば、電流(または電荷)応答は拡散速度と同様、不均一電子移動速度によって影響されるでしょう。従って 電子移動速度はCA とCC によって測定されます。
CC はCA に比べて幾つかの利点があります。 シグナルは時間と共に増加します。応答後半部分ははじめに集中する充電電流により歪められないので、良いS/N 比が得られます。加えて、電荷が実験中に加算されるので、初期応答からのインフォメーションも保持されます。
初期情報を保持することができる点を利用する別のCC の応用は作用電極の表面に吸着した種の検出です 。このような種はポテンシャルが変化するやいなや、非常に速く電解されます。 クロノクーロメトリーの間に測定される総電荷は
Qdl は作用電極の充電による電荷量、 Qads は吸着種の電解による電荷量で吸着物質の表面濃度に比例します。 3つの成分のうち、 Qdiff だけ が時間に依存します。従って、Anson プロットの切片はQdl + Qads になります。Qads を算出する1つの方法はバックグラウンド溶液でCC 実験を行なうことによりQdl を測定し差を求めることです。
しかし、これは電気化学活性な種の有無に関わらずQdl は同じであると仮定しています。これは必ずしも真実でありません。一層正確な方法はダブルステップCC を使うことです。
Qdl はフォワード/ リバースのAnson プロット(図9)の切片の差を計算することにより除去できるからです。