トップページ > 電気化学測定用電極・セル > 参照電極一覧 > これから電気化学を始める方のための参照電極の基礎
電気化学測定に使用する参照電極の種類とその用途、選択方法についての基礎的な内容です。
その他はこちら
電位は液中の水素イオンの濃度(活量aH+)と水素ガス分圧(pH2)に依存する。白金(表面積を稼ぐために白金黒化した)がこの反応の活性が高いので電極として用いられる。プロトン活量1の溶液(1.16モル塩酸溶液がこれに近い)中に1バールの水素をバブルし、上記白金電極を浸漬すると標準水素電極となる(右図)。
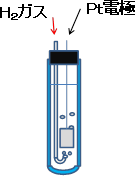
プロトン活量1、水素分圧1バールの標準状態においてE0=0と約束して、電位の一次標準として使われる(SHE電位スケールにおけるゼロ電位)。しかし、実際の測定に際して標準状態を規定することは、必ずしも、それほど簡単なことではないし、水素ガスを常時流し続けることは不便である。そのため、通常は既に述べた参照電極(主として銀-塩化銀電極やカロメル電極)を使い、既知の電位差を補正してSHEスケール表示にする便法が採られることが多い。例えば、SCEを使った場合、SHE=SCE + 0.241(V)等である。
場合によっては標準水素電極に近い状態を得る便宜的方法として、可逆水素電極(reversible hydrogen electrode、RHE)と称されるものが使われている。この呼び方自体、誤解を受けそうであるが広く使われている。水素吸蔵金属であるパラジウム電極を用いる方法などもあるが、ビー・エー・エスの製品(品名;RHEK簡易型可逆水素電極キットおよびダブルジャンクションチャンバーキット)では、白金電極を用いて強酸(1.2M塩酸または0.5M硫酸など)中、陽分極で水素を発生させることにより、一時的に使用可能な水素電極をつくるやりかたをとる。使用の度にマニュアルに従って自ら調製するのであるが、ダブルジャンクションキットと併用することにより、酸性被検液のみならず、中性被検液中の使用が可能である。カロメル電極や銀塩化銀電極の電位との比較から、標準水素電極に近い電位を示すことがわかる。
ビー・エー・エス社のRHEKでは、先ず、電極主部に電解液(1.2モルHCl水溶液など)を吸い上げ(下図左端)、陰分極(還元)で一定時間、水素を発生させ、主部に貯留する(下図中左)。その後、被検液(酸性溶液の場合)に電極を移し、測定に供する(下図中右)。被検液が中性溶液などでは一旦、ジャンクション部を介して同様の操作の後、ジャンクションごと被検液に移し測定できる(下図右端)。

電気化学測定に使用する参照電極の種類とその用途、選択方法についての基礎的な内容です。
その他はこちら
これから電気化学を始める方のための参照電極の基礎-その6:標準水素電極
電極反応は 2H+ + 2e ⇄ H2 であり、電位の式は次のように与えられる。
E = E0 + (RT/F) ln aH+ - (RT/2F) ln pH2

プロトン活量1、水素分圧1バールの標準状態においてE0=0と約束して、電位の一次標準として使われる(SHE電位スケールにおけるゼロ電位)。しかし、実際の測定に際して標準状態を規定することは、必ずしも、それほど簡単なことではないし、水素ガスを常時流し続けることは不便である。そのため、通常は既に述べた参照電極(主として銀-塩化銀電極やカロメル電極)を使い、既知の電位差を補正してSHEスケール表示にする便法が採られることが多い。例えば、SCEを使った場合、SHE=SCE + 0.241(V)等である。
場合によっては標準水素電極に近い状態を得る便宜的方法として、可逆水素電極(reversible hydrogen electrode、RHE)と称されるものが使われている。この呼び方自体、誤解を受けそうであるが広く使われている。水素吸蔵金属であるパラジウム電極を用いる方法などもあるが、ビー・エー・エスの製品(品名;RHEK簡易型可逆水素電極キットおよびダブルジャンクションチャンバーキット)では、白金電極を用いて強酸(1.2M塩酸または0.5M硫酸など)中、陽分極で水素を発生させることにより、一時的に使用可能な水素電極をつくるやりかたをとる。使用の度にマニュアルに従って自ら調製するのであるが、ダブルジャンクションキットと併用することにより、酸性被検液のみならず、中性被検液中の使用が可能である。カロメル電極や銀塩化銀電極の電位との比較から、標準水素電極に近い電位を示すことがわかる。
ビー・エー・エス社のRHEKでは、先ず、電極主部に電解液(1.2モルHCl水溶液など)を吸い上げ(下図左端)、陰分極(還元)で一定時間、水素を発生させ、主部に貯留する(下図中左)。その後、被検液(酸性溶液の場合)に電極を移し、測定に供する(下図中右)。被検液が中性溶液などでは一旦、ジャンクション部を介して同様の操作の後、ジャンクションごと被検液に移し測定できる(下図右端)。

pdf資料はこちらからダウンロードできます(約140KB)
トップページ|電気化学 測定|電極&アクセサリ|光と電気化学|分光分析|お問い合わせ
