トップページ > 電気化学測定用電極・セル > 参照電極一覧 > これから電気化学を始める方のための参照電極の基礎
電気化学測定に使用する参照電極の種類とその用途、選択方法についての基礎的な内容です。
その他はこちら
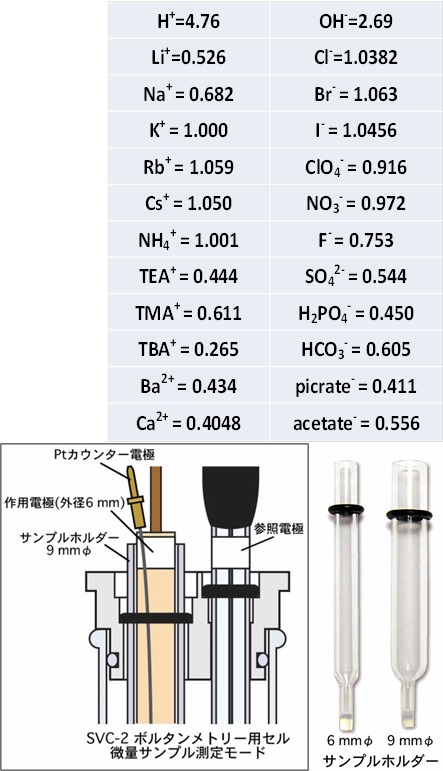
参照電極と被検液の間に塩橋を使う場合は、新たに溶液界面を増やすことであるからこの辺のことを念頭に置いて、できるだけ大きな液間電位が生じないような塩橋の組成などに注意することである。 K+、NH4+、Cl-、NO3-の組み合わせがよく使われる。KClの溶解度は低い(飽和で4.8 M程度)のでその代替としてコスト的に不利であるがCsClやRbClが使われることがある。これはRb、Cs、Clの易動度がほぼ同じであるためである。KClを1.000とした時の相対的易動度を右表にあげる。
参照電極の内部液にKClではなくNaClを使うことがあるが、これは過塩素酸アニオン(ClO4-)が被検液に含まれる場合に対応してのことである。過塩素酸カリウムと過塩素酸ナトリウムの水への溶解度は100倍以上異なり、後者の方が良く溶ける。過塩素酸カリウムの溶解度が低すぎるのである。そのため被検液にClO4-が含まれるとKCl溶液が内部液だと、液絡部に塩が析出して大きなトラブルの元になる。液間電位の大小と実利との損得を諮っての選択ということである。
ビー・エー・エスでは塩橋を作成するのに便利な先端にポーラスなフリットを持つサンプルホルダーを取り扱っている(外径が6 mmと9 mmのものがある)。サンプルホルダー自身、内部液を自分で調製(溶媒、支持電解質、銀塩を選んで)することで銀イオン参照電極用として使用できる他、9 mm外径のものでは6 mm外径の参照電極用の塩橋のホルダーとなる。外径、内径それぞれ9 mm、6 mmのサンプルホルダーでは微小量の電気化学測定が可能である。外径6 mmの作用電極と対極をサンプルホルダー中に収め、SVC-2ボルタンメトリーセルに参照電極と一緒に収める形の2室型 セルを構成して100~200 µl程度の試料の測定ができる。
pdf資料はこちらからダウンロードできます(約140KB)
トップページ|電気化学 測定|電極&アクセサリ|光と電気化学|分光分析|お問い合わせ
電気化学測定に使用する参照電極の種類とその用途、選択方法についての基礎的な内容です。
その他はこちら
これから電気化学を始める方のための参照電極の基礎-その7:液間電位について
参照電極を使用すると、その内部液と被検液の間に必ず液々界面ができる。異なる液相間をイオンでもって電気的導通を得るのに塩橋と呼ばれるものを使うと、更に余分の界面が増える。
このような二つの液々界面には両液相の組成に応じて液間界面電位が発生する。液相に含まれる電解質の構成イオンの動き易さ(易動度)の違いに原因がある。発生する液間電位の大きさはヘンダーソンの式を用いると計算できる。カチオン、アニオンの易動度の差と濃度とイオン価数が入った込み入った式である。式上、効くのは濃度の大きい成分で、希薄な成分は無視できるので簡単化して使うことができる。
液間電位をできるだけ小さくするための要諦は支持塩の構成をカチオンとアニオンのイオン易動度が近いものを選んで、できるだけ高濃度で使うということになる。例えばK+イオンと塩化物イオンの易動度は似通っているが、Na+イオンの易動度はK+イオンの7割弱の易動度しかないのでKClの方がNaClより有利になるし、HClではプロトンと塩化物イオンの易動度が著しく異なるので不利になるということが云える(プロトンの方が5倍くらい速い)。HClの溶液を使わざるをえない時は、接するもう一方の溶液の塩濃度(KClなど)をできるだけ濃くするということである。そのようなわけで1M NaClと1MKClの水溶液界面では4.3 mVの界面電位だが、1M NaClと3M KClの水溶液界面電位では1.7 mVになるし、1M HClと1M KCl水溶液では27 mVで、1M HClと3M KCl水溶液では16 mVに減少する。
参照電極の内部液にKClではなくNaClを使うことがあるが、これは過塩素酸アニオン(ClO4-)が被検液に含まれる場合に対応してのことである。過塩素酸カリウムと過塩素酸ナトリウムの水への溶解度は100倍以上異なり、後者の方が良く溶ける。過塩素酸カリウムの溶解度が低すぎるのである。そのため被検液にClO4-が含まれるとKCl溶液が内部液だと、液絡部に塩が析出して大きなトラブルの元になる。液間電位の大小と実利との損得を諮っての選択ということである。
ビー・エー・エスでは塩橋を作成するのに便利な先端にポーラスなフリットを持つサンプルホルダーを取り扱っている(外径が6 mmと9 mmのものがある)。サンプルホルダー自身、内部液を自分で調製(溶媒、支持電解質、銀塩を選んで)することで銀イオン参照電極用として使用できる他、9 mm外径のものでは6 mm外径の参照電極用の塩橋のホルダーとなる。外径、内径それぞれ9 mm、6 mmのサンプルホルダーでは微小量の電気化学測定が可能である。外径6 mmの作用電極と対極をサンプルホルダー中に収め、SVC-2ボルタンメトリーセルに参照電極と一緒に収める形の2室型 セルを構成して100~200 µl程度の試料の測定ができる。

pdf資料はこちらからダウンロードできます(約140KB)
トップページ|電気化学 測定|電極&アクセサリ|光と電気化学|分光分析|お問い合わせ
